CISENDO® - GIẢI PHÁP DNA METHYLATION TRONG SÀNG LỌC UNG THƯ NỘI MẠC TỬ CUNG
Trong lâm sàng, đa số bệnh nhân đến vì chảy máu bất thường - một triệu chứng rất điển hình của ung thư nội mạc tử cung, nhưng chỉ một tỷ lệ rất nhỏ trong số họ thật sự là ung thư. Điều này đặt bác sĩ vào một tình thế khó: Làm sao để không bỏ sót ung thư, nhưng cũng không được để bệnh nhân bị sinh thiết không cần thiết?
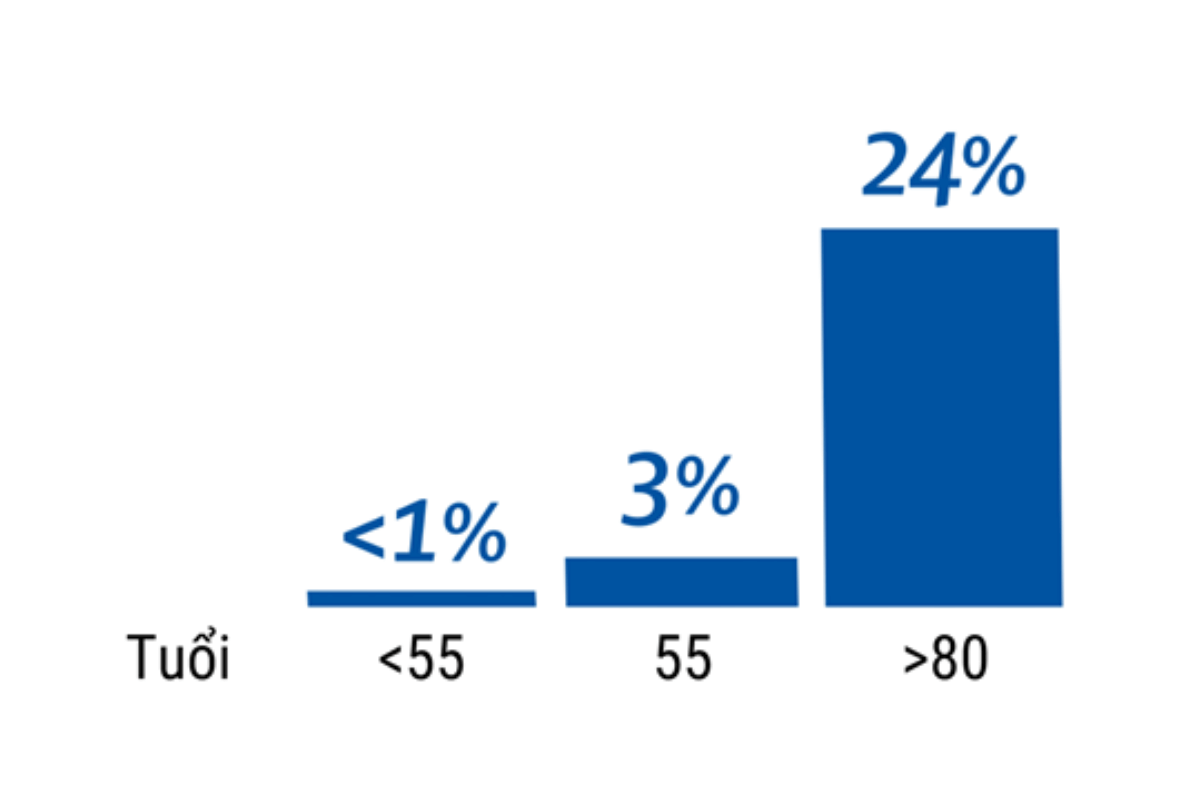
Hình 1: Tỷ lệ ung thư nội mạc tử cung ở những phụ nữ chảy máu bất thường theo độ tuổi [1].
SIÊU ÂM ĐẦU DÒ ÂM ĐẠO (TVU) – CÔNG CỤ TỐT NHƯNG CHƯA ĐỦ
Siêu âm đầu dò âm đạo (TVU) là bước đầu tiên và gần như “bắt buộc” trong đánh giá chảy máu bất thường. Phương pháp này rất nhạy, nhưng độ đặc hiệu lại thấp, chỉ khoảng 50%. Ở phụ nữ sau mãn kinh, nội mạc ≥5 mm có thể là ung thư, nhưng xác suất tới 80% không phải (PPV chỉ 20%) (Bảng 1).
Bên cạnh đó, khoảng 25–34% ung thư nội mạc tử cung loại 2 (nhóm nguy hiểm nhất) có kết quả siêu âm bình thường hoặc không rõ ràng.
Hai khoảng trống này tồn tại đã lâu và đó lý do tại sao lâm sàng cần thêm một phương pháp sàng lọc không xâm lấn, đặc hiệu cao, vừa giúp giảm số ca sinh thiết, vừa giúp hạn chế bỏ sót ung thư loại 2.
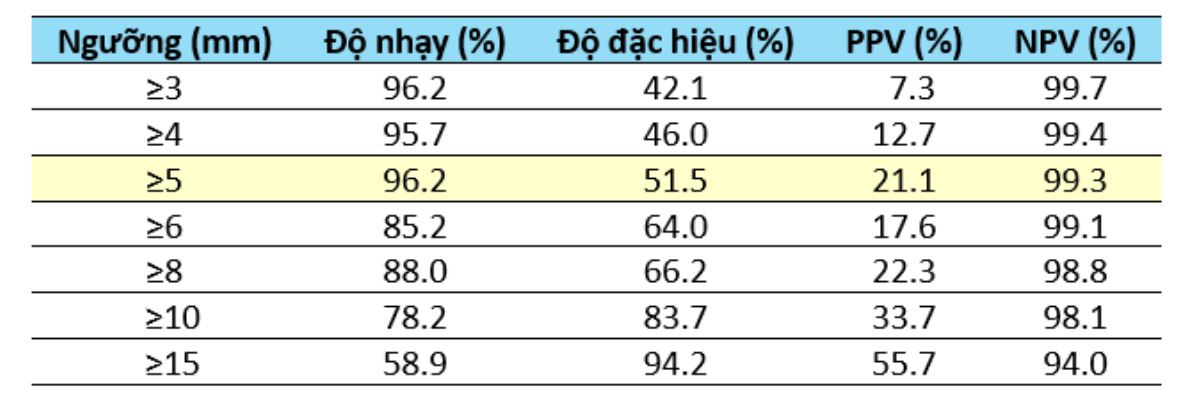
Bảng 1: Hiệu quả sàng lọc ung thư nội mạc tử cung của siêu âm đầu dò âm đạo (TVU) theo từng giá trị ngưỡng ở phụ nữ sau mãn kinh [3].
CDO1 & CELF4 METHYLATION – VÌ SAO GIỚI KHOA HỌC QUAN TÂM?
Trong nhiều năm qua, các nhà khoa học đã nỗ lực tìm kiếm tìm kiếm một dấu ấn sinh học (marker) đủ ổn định, đặc hiệu, để phát hiện ung thư. Và họ nhận thấy DNA methylation đáp ứng tiêu chí này, đó là cơ chế mà tế bào ung thư “vô hiệu hoá” các gene ức chế khối u (TSG) vốn có nhiệm vụ bảo vệ chúng ta.
Điều đặc biệt hơn: các tế bào ung thư nội mạc tử cung cũng hiện diện ở cổ tử cung, nơi mà chúng ta có thể lấy mẫu an toàn, không xâm lấn (Hình 2).
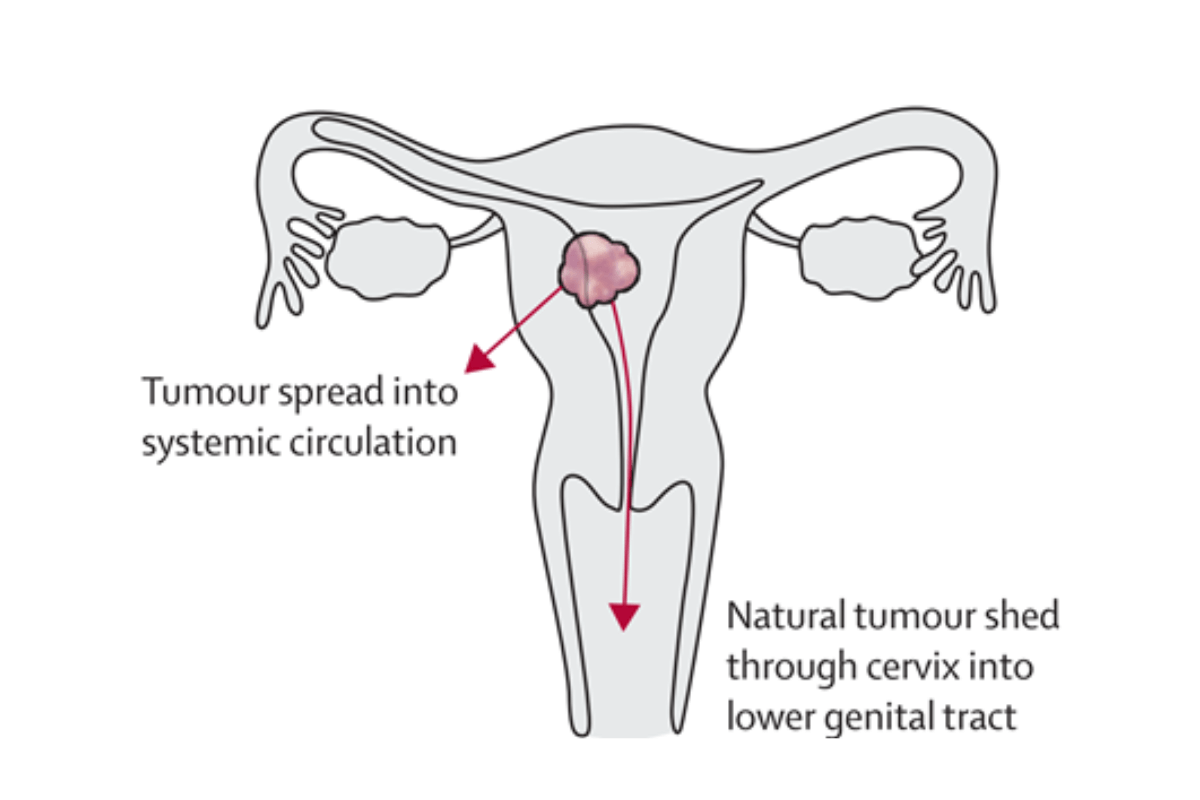
Hình 2: Tế bào khối u nội mạc tử cung có thể được tìm thấy trong máu và ở vùng cổ tử cung trong tự nhiên [1].
Nhóm của Huang và cộng sự (2017) đã phân tích methylation trên toàn bộ gene (whole methylome) trên hàng trăm mẫu khối u nội mạc tử cung và hàng chục mẫu mô lành lân cận, cùng với nhiều bước thẩm định trên mẫu thật để tìm ra CDO1 và CELF là hai “quán quân” trong phát hiện ung thư nội mạc tử cung (Hình 3).
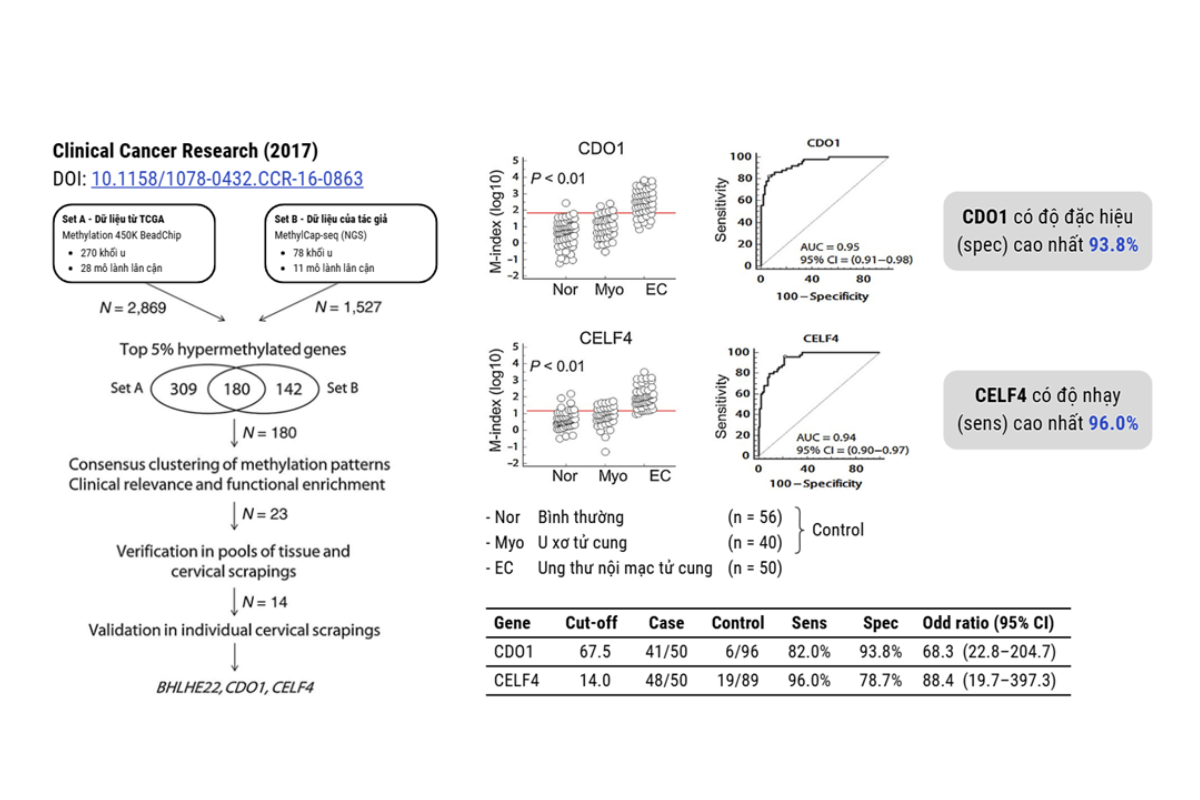
Hình 3: Tóm tắt quy trình và kết quả nghiên cứu của Huang và cộng sự (2017).
CISENDO® – TIỀM NĂNG LẤP ĐẦY KHOẢNG TRỐNG TẠI VIỆT NAM
Từ các bằng chứng khoa học, hãng Cispoly đã phát triển giải pháp Human CDO1 & CELF4 Methylation Detection Kit (CISENDO®) cho phép sàng lọc ung thư nội mạc tử cung thông qua phát hiện sự methyl hoá các gene CDO1 và CELF4 với nguồn mẫu không xâm lấn.
Bên cạnh công nghệ real-time PCR quen thuộc, giải pháp CISENDO® đã được Bộ y tế cấp GPLH loại C tạo điều kiện cho các bệnh viện, trung tâm xét nghiệm có thể lập tức triển khai xét nghiệm để xây dựng một quy trình sàng lọc kết hợp siêu âm (TVU) và CISENDO®.
Trong một nghiên cứu lâm sàng quy mô tương đối lớn (n=607) của Qi và cộng sự (2023), kết quả cho thấy CISENDO® có thể kết hợp siêu âm (TVU) để phân tầng nguy cơ dựa trên 4 tình huống (Bảng 2).
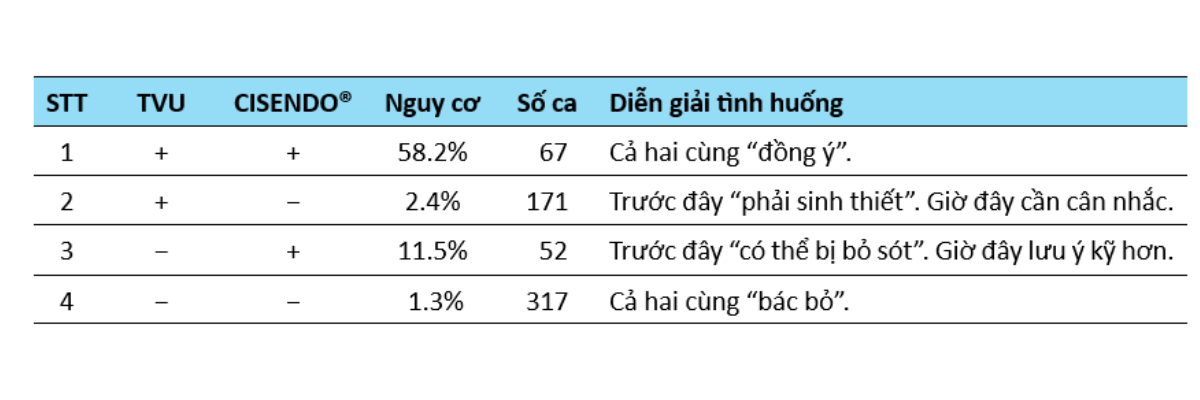
Bảng 2: Kết quả sàng lọc AH/EC kết hợp CISENDO và siêu âm (TVU). Trong đó AH là nội mạc tử cung tăng sản không điển hình và EC là ung thư nội mạc tử cung.
TỔNG KẾT VỀ GIÁ TRỊ TRONG LÂM SÀNG CỦA CISENDO®
CISENDO® không thay thế siêu âm (TVU), cũng không cạnh tranh với sinh thiết. Vai trò của xét nghiệm này là bổ sung mảnh ghép còn thiếu cho các vùng xám trong lâm sàng.
Đó là:
- - Giảm số ca sinh thiết không cần thiết.
- - Bổ sung bằng chứng khi siêu âm bình thường, nhưng nghi ngờ ung thư.
- - Mở ra cách tiếp cận an toàn, dễ chấp nhận và ít xâm lấn hơn.
Trao cho bác sĩ một công cụ khách quan để đưa ra quyết định khó khăn.
MỘT SỐ ĐIỂM NỔI BẬT ĐÁNG CHÚ Ý CỦA CISENDO®
- - Đã có GPLH loại C – sẵn sàng triển khai tại Việt Nam
- - Dựa trên 2 gene methyl hóa nhạy và đặc hiệu: CDO1 & CELF4
- - Nguồn mẫu: tế bào cổ tử cung – dễ thu nhận, không xâm lấn
- - Tương thích với nhiều hệ thống real-time PCR phổ biến
- - Hỗ trợ phân tầng nguy cơ khi kết hợp siêu âm (TVU), giúp giảm xâm lấn không cần thiết và giúp giảm thiểu bỏ sót ung thư nội mạc tử cung loại 2.
TÀI LIỆU THAM KHẢO
1/ Crosbie, E. J., et al. (2022). Endometrial cancer. The Lancet, 399(10333), 1412-1428.
2/ Huang, R. et al. (2017). Integrated epigenomics analysis reveals a DNA methylation panel for endometrial cancer detection using cervical scrapings. Clinical Cancer Research, 23(1), 263-272.
3/ Long, B., et al. (2020). Ultrasound detection of endometrial cancer in women with postmenopausal bleeding: Systematic review and meta-analysis. Gynecologic oncology, 157(3), 624-633.
4/ Qi, B., et al. (2023). Hypermethylated CDO1 and CELF4 in cytological specimens as triage strategy biomarkers in endometrial malignant lesions. Frontiers in Oncology, 13, 1289366.









 ĐKKD:
ĐKKD: 
